Bei Typ-2-Diabetes (T2D) verlieren die Beta-Zellen der Bauchspeicheldrüse nach und nach ihre Fähigkeit, ausreichend Insulin zur Regulierung des Blutzuckerspiegels zu produzieren. Aber welche molekularen Prozesse finden in diesen Zellen auf dem Weg zur Diabeteserkrankung statt? Ein besseres Verständnis dieser Prozesse hätte erhebliche Auswirkungen auf die Prävention und Behandlung von Diabetes, ist jedoch bislang weitgehend unerforscht. Dank eines einzigartigen Datensatzes von lebenden Spendern und innovativer Multi-Omics-Analysen konnte ein internationales Forscherteam unter der Leitung von Wissenschaftlern des Paul-Langerhans-Instituts Dresden (PLID), des SIB Swiss Institute of Bioinformatik und des Max-Planck-Instituts (MPI) für Biochemie neue Erkenntnisse über die Prozesse gewinnen, die zur Funktionsstörung der Inselzellen führen. Die Ergebnisse dieser gemeinsamen Studie, die Teil des IMI-Projekts RHAPSODY ist, wurden in der Fachzeitschrift Nature Metabolism veröffentlicht.
Über RHAPSODY
Diese Studie wurde teilweise durch die Innovative Medicines Initiative RHAPSODYfinanziert , eine öffentlich-private Partnerschaft zwischen der Europäischen Union – vertreten durch die Europäische Kommission – und der Pharmaindustrie, die Forscher und Experten aus 26 Partnerinstitutionen des öffentlichen und privaten Sektors zusammenbringt und in der SIB sein Fachwissen zur Koordinierung der Integration und Analyse klinischer Daten einbringt.
Nicht alle T2D-Beta-Zellen werden auf dieselbe Weise funktionsunfähig
Bei Menschen mit T2D wurde die Hypothese aufgestellt, dass die Beta-Zellen der Inselzellen nach einer „De-Programmierung“ funktionsunfähig werden und in ihren Vorläuferzustand zurückfallen. Diese Studie zeigt jedoch erstmals, dass die Genexpression und das Proteomprofil der Inselzellen bei Menschen mit T2D sehr unterschiedlich sind, während sie bei Nicht-Diabetikern bemerkenswert homogen sind. Mit anderen Worten: Die Betazellen scheinen durch unterschiedliche molekulare Prozesse bei verschiedenen Menschen funktionsunfähig zu werden, anstatt bei allen Menschen denselben „Reset“-Weg zu durchlaufen. Dies bestätigt die Annahme, dass es keine einheitliche Behandlungsmethode für T2D gibt, und unterstreicht die Notwendigkeit eines personalisierten Ansatzes.
Potenzielle Biomarker zur Überwachung von Krankheiten
Dank der innovativen Integration von Lipidomik, Transkriptomik und klinischen Daten lebender Spender (siehe unten), die von der SIB-Gruppe für Computational Biology Vital-IT durchgeführt wurde, konnten mehrere Gene der Langerhans-Inseln der Bauchspeicheldrüse und aus dem Blutplasma der Spender gewonnene Lipide identifiziert werden, die mit einem hohen Blutzuckerspiegel in Verbindung stehen.
- ALDOB (Aldolase B) sticht als das Gen hervor, das am stärksten mit Hyperglykämie assoziiert ist, und seine Expression war bei T2D sowohl auf Transkript- als auch auf Proteinebene stark erhöht.
- Darüber hinaus wurde erstmals eine Reihe von Genen identifiziert, deren Expression bereits bei Patienten mit gestörter Glukosetoleranz, aber noch ohne T2D-Diagnose, verändert war.
- Schließlich wurden auch mehrere Lipidklassen (d. h. Phospholipide und Dihydroceramide) als potenzielle Biomarker für die Erkrankung identifiziert.
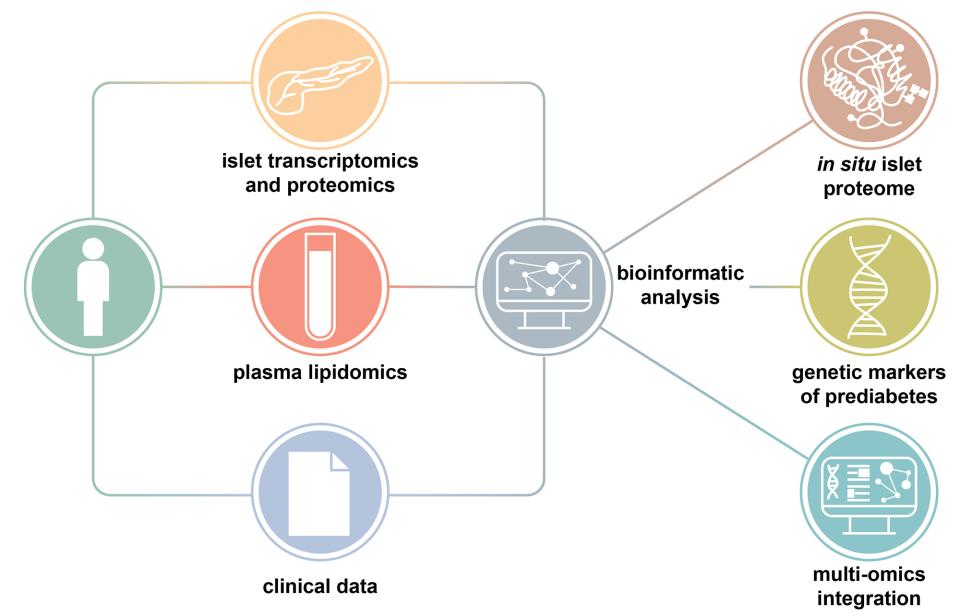
Eine wertvolle Ressource zur Untersuchung des Prädiabetes-Diabetes-Kontinuums
Bislang waren die subtilen molekularen Prozesse, die auf dem Weg zu Diabetes ablaufen, Wissenschaftlern verborgen geblieben, da Daten zur menschlichen Bauchspeicheldrüse in der Regel von verstorbenen Spendern stammten. „Im Gegensatz dazu liefert diese Studie die erste umfassende Analyse von Inselzellen in situ und Plasmaproben aus der größten Kohorte lebender Spender mit detailliertem Stoffwechselprofil“, sagt Leonore Wigger, Computational Scientist bei SIB und Co-Erstautorin der Studie. Dieser Ansatz ermöglichte es, die üblichen Mängel von Daten verstorbener Spender zu umgehen, die nur als diabetisch oder nicht diabetisch charakterisiert werden können, sich aber auch in einem besonderen metabolischen Stresszustand befinden, der mit dem Endstadium des Spenders verbunden ist, und für die keine umfassenden klinischen und Laborinformationen vorliegen. „Multi-Omics-Daten wurden somit unter Verwendung modernster Ansätze generiert und auf eine Weise integriert, die bisher in Studien zur Inseldysregulation im Zusammenhang mit Hyperglykämie beim Menschen noch nicht verwendet wurde.“
Mark Ibberson, Direktor der SIB-Gruppe Computational biology Vital-IT und Co-Projektleiter der Studie, fasst zusammen: «Die Ergebnisse dieser Studie verändern unsere Vorstellung davon, wie die Bauchspeicheldrüse bei T2D geschädigt wird, und liefern einen einzigartigen Datensatz mit Transkriptom- und Proteomdaten, der für weitere Entdeckungen genutzt werden kann, beispielsweise als Ergänzung zu bestehenden Datensätzen.»
Reference(s)
Wigger L, Barovic M, Brunner A-D et al. Multi-Omics-Profiling lebender Spender menschlicher Pankreasinseln zeigt heterogene Verläufe der Betazellen in Richtung Typ-2-Diabetes. Nature Metabolism 2021.