Dans le diabète de type 2 (DT2), les cellules bêta des îlots pancréatiques deviennent progressivement incapables de sécréter suffisamment d'insuline pour réguler la glycémie. Mais quels sont les processus moléculaires qui se déroulent à l'intérieur de ces cellules au cours du développement du diabète ? La compréhension de ces processus aurait un impact majeur sur la prévention et le traitement du diabète, mais elle échappe encore largement aux scientifiques. Grâce à un ensemble unique de données provenant de donneurs vivants et à une analyse multi-omique innovante, une équipe internationale de chercheurs dirigée par des chercheurs de l'Institut Paul-Langerhans de Dresde (PLID), du SIB Institut Suisse de Bioinformatique et de l'Institut Max-Planck (MPI) de biochimie a mis en lumière les processus à l'origine du dysfonctionnement des îlots pancréatiques. Les résultats de cette étude collaborative, qui s'inscrit dans le cadre du projet IMI RHAPSODY, sont publiés dans la revue Nature Metabolism.
À propos de RHAPSODY
Cette étude a été financée en partie par l'Initiative en matière de médicaments innovants RHAPSODY, un partenariat public-privé entre l'Union européenne – représentée par la Commission européenne – et l'industrie pharmaceutique, qui réunit des chercheurs et des experts de 26 institutions partenaires des secteurs public et privé, et dans le cadre duquel le SIB offre son expertise pour coordonner l'intégration et l'analyse des données cliniques.
Toutes les cellules bêta du T2D ne deviennent pas dysfonctionnelles de la même manière
Chez les personnes atteintes de DT2, on a émis l'hypothèse que les cellules bêta des îlots pancréatiques devenaient dysfonctionnelles à la suite d'une « déprogrammation », qui les ramenait à leur état précurseur. Cependant, cette étude montre pour la première fois que l'expression génétique et le profil protéomique des cellules des îlots pancréatiques chez les personnes atteintes de DT2 sont très divergents, alors qu'ils sont remarquablement homogènes chez les sujets non diabétiques. En d'autres termes, les cellules bêta semblent devenir dysfonctionnelles par différents processus moléculaires chez différentes personnes, plutôt que de suivre la même voie de « réinitialisation » chez tous les individus. Cela renforce l'idée qu'il n'existe pas de traitement unique pour le DT2 et confirme la nécessité d'une approche personnalisée.
Biomarqueurs potentiels pour surveiller la maladie
Grâce à l'intégration innovante de la lipidomique, de la transcriptomique et des données cliniques provenant de donneurs vivants (voir ci-dessous), réalisée par le groupe de biologie computationnelle Vital-IT du SIB, l'étude a identifié plusieurs gènes des îlots pancréatiques et des lipides extraits du plasma sanguin des donneurs, associés à un taux élevé de sucre dans le sang.
- ALDOB (aldolase B) se distingue comme le gène le plus associé à l'hyperglycémie et son expression s'est avérée fortement élevée dans le DT2, tant au niveau des transcrits que des protéines.
- En outre, l'étude a révélé pour la première fois un ensemble de gènes dont l'expression était déjà altérée chez des patients présentant une intolérance au glucose, mais qui n'avaient pas encore été diagnostiqués avec un DT2.
- Enfin, plusieurs classes de lipides (phospholipides et dihydrocéramides) ont également été identifiées comme biomarqueurs potentiels de la maladie.
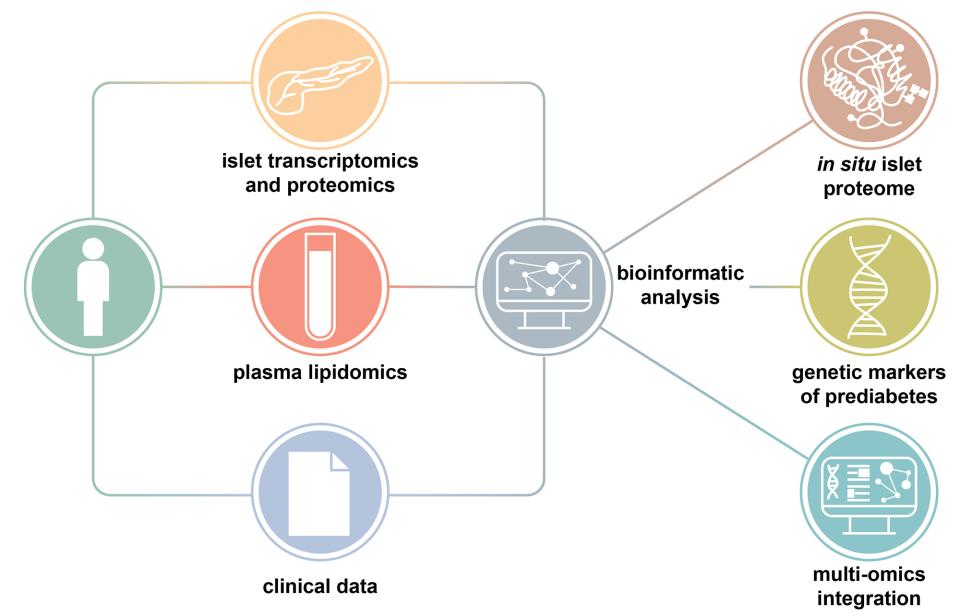
Une ressource précieuse pour étudier le continuum prédiabétique-diabétique
Jusqu'à présent, les processus moléculaires subtils qui se déroulent au cours du développement du diabète échappaient aux scientifiques, car les données sur les îlots pancréatiques humains provenaient généralement de donneurs décédés. « En revanche, cette étude fournit la première analyse approfondie des îlots in situ et des échantillons de plasma provenant de la plus grande cohorte de donneurs vivants ayant fait l'objet d'un profilage métabolique approfondi », explique Leonore Wigger, scientifique en informatique au SIB et co-auteure principale de l'étude. Cette approche a permis de contourner les lacunes habituelles associées aux données provenant de donneurs décédés, qui ne peuvent être caractérisées que comme diabétiques ou non diabétiques, mais qui se trouvent également dans un état de stress métabolique particulier lié à l'état terminal du donneur et pour lesquelles on manque d'informations cliniques et de laboratoire approfondies. « Des données multi-omiques ont ainsi été générées à l'aide d'approches de pointe et intégrées d'une manière inédite dans les études sur la dérégulation des îlots pancréatiques en relation avec l'hyperglycémie chez l'homme. »
Mark Ibberson, directeur du groupe de biologie computationnelle Vital-IT du SIB et co-chercheur principal de l'étude, conclut : « Les résultats de cette étude changent notre façon de comprendre comment le pancréas est endommagé dans le DT2 et fournissent un ensemble unique de données transcriptomiques et protéomiques qui peuvent être utilisées pour permettre de nouvelles découvertes, par exemple en complément des ensembles de données existants. »
Reference(s)
Wigger L, Barovic M, Brunner A-D et al. Le profilage multi-omique de donneurs vivants d'îlots pancréatiques humains révèle des trajectoires hétérogènes des cellules bêta vers le diabète de type 2. Nature Metabolism 2021.