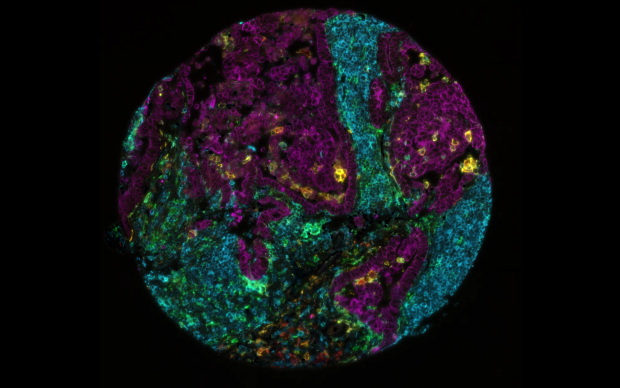
Nel diabete di tipo 2 (T2D), le cellule beta delle isole pancreatiche diventano gradualmente incapaci di secernere una quantità sufficiente di insulina per regolare i livelli di glucosio nel sangue. Ma quali sono i processi molecolari che avvengono all'interno di queste cellule lungo il percorso che porta al diabete? La comprensione di tali processi avrebbe un impatto significativo sulla prevenzione e sul trattamento del diabete, ma finora è sfuggita in gran parte agli scienziati. Grazie a un dataset unico proveniente da donatori viventi e a un'innovativa analisi multi-omica, un team di ricerca internazionale guidato dai ricercatori del Paul-Langerhans-Institute Dresden (PLID), del SIB Istituto Svizzero di Bioinformatica e del Max-Planck-Institute (MPI) of Biochemistry ha fatto luce sui processi che causano la disfunzione delle isole pancreatiche. I risultati di questo studio collaborativo, parte del progetto IMI RHAPSODY, sono stati pubblicati sulla rivista Nature Metabolism.
Informazioni su RHAPSODY
Questo studio è stato finanziato in parte dall'Iniziativa sui medicinali innovativi RHAPSODY, una partnership pubblico-privata tra l'Unione Europea – rappresentata dalla Commissione Europea – e l'industria farmaceutica, che riunisce ricercatori ed esperti provenienti da 26 istituzioni partner sia del settore pubblico che privato, e in cui il SIB offre la propria competenza per coordinare l'integrazione e l'analisi dei dati clinici.
Non tutte le cellule beta del T2D diventano disfunzionali allo stesso modo
Nelle persone affette da T2D, è stato ipotizzato che le cellule beta delle isole pancreatiche diventino disfunzionali in seguito a una "deprogrammazione", che le riporta al loro stato precursore. Tuttavia, questo studio dimostra per la prima volta che l'espressione genica e il profilo proteomico delle cellule delle isole pancreatiche negli individui affetti da T2D sono molto divergenti, mentre sono notevolmente omogenei nelle cellule delle isole pancreatiche dei soggetti non diabetici. In altre parole, le cellule beta sembrano diventare disfunzionali attraverso processi molecolari diversi in persone diverse, piuttosto che seguire lo stesso percorso di "reset" in tutti gli individui. Ciò rafforza l'idea che non esiste un unico approccio valido per tutti per trattare il diabete di tipo 2 e sostiene la necessità di un approccio personalizzato.
Potenziali biomarcatori per monitorare la malattia
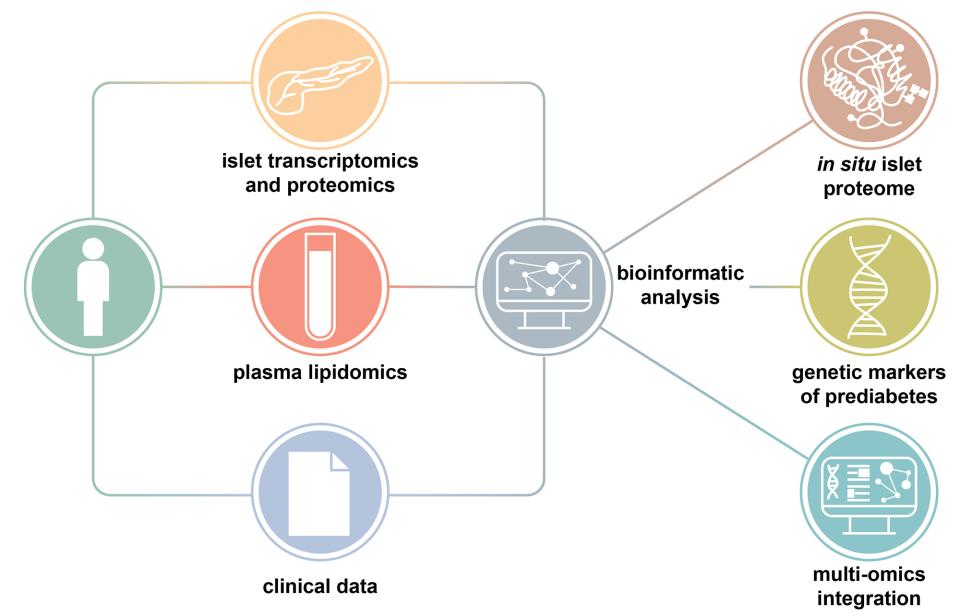
Grazie all'integrazione innovativa di lipidomica, trascrittomica e dati clinici provenienti da donatori viventi (leggi sotto), effettuata dal gruppo di biologia computazionale Vital-IT del SIB, lo studio ha identificato diversi geni delle isole pancreatiche e lipidi recuperati dal plasma sanguigno dei donatori, associati a livelli elevati di zucchero nel sangue.
- ALDOB (Aldolasi B) si distingue come il gene più associato all'iperglicemia e la sua espressione è risultata fortemente elevata nel T2D sia a livello di trascritto che di proteina.
- Inoltre, lo studio ha rivelato per la prima volta un insieme di geni la cui espressione era già alterata in pazienti con ridotta tolleranza al glucosio, ma che non erano ancora stati diagnosticati con T2D.
- Infine, diverse classi di lipidi (cioè fosfolipidi e diidroceramidi) sono state identificate come potenziali biomarcatori della malattia.
Una risorsa preziosa per studiare il continuum prediabetico-diabetico
Finora, i sottili processi molecolari che avvengono lungo il percorso verso il diabete sfuggivano agli scienziati perché i dati relativi alle isole pancreatiche umane provenivano solitamente da donatori deceduti. «Al contrario, questo studio fornisce la prima analisi approfondita sulle isole in situ e sui campioni di plasma provenienti dalla più grande coorte di donatori viventi con profilo metabolico approfondito», afferma Leonore Wigger, scienziata computazionale al SIB e coautrice dello studio. Questo approccio ha permesso di aggirare le consuete carenze associate ai dati provenienti da donatori deceduti, che possono essere caratterizzati solo come diabetici o non diabetici, ma che si trovano anche in uno stato particolare di stress metabolico associato alla condizione terminale del donatore e privi di informazioni cliniche e di laboratorio approfondite. "I dati multi-omici sono stati quindi generati utilizzando approcci all'avanguardia e integrati in un modo mai utilizzato prima negli studi sulla disregolazione delle isole pancreatiche in relazione all'iperglicemia nell'uomo".
Mark Ibberson, direttore del gruppo di biologia computazionale Vital-IT del SIB e co-ricercatore principale dello studio, conclude: «I risultati di questo studio cambiano il modo in cui pensiamo al danneggiamento del pancreas nel T2D e forniscono un set di dati unico di dati trascrittomici e proteomici che può essere utilizzato per consentire ulteriori scoperte, ad esempio come integrazione ai set di dati esistenti».
Reference(s)
Wigger L, Barovic M, Brunner A-D et al. Il profilo multi-omico dei donatori viventi di isole pancreatiche umane rivela traiettorie eterogenee delle cellule beta verso il diabete di tipo 2. Nature Metabolism 2021.